Een been aangroeien als een kreeft, kunnen wij dat ook?
Kreeften kunnen verloren ledematen opnieuw aangroeien. Als de natuur die gave al een keer ontwikkeld heeft, zouden wij dat dan ook kunnen?
Dat is een vraag die wetenschappers al bezighoudt sinds de jaren ’50 van de vorige eeuw, toen voor het eerst stamcellen van menselijke huidcellen gemaakt waren. Dit was een revolutionaire stap, want met stamcellen kunnen allerlei verschillende soorten cellen en weefsels gemaakt worden. De afgelopen decennia zijn de technieken verder ontwikkeld, en in de nabije toekomst zal deze regeneratieve geneeskunde wellicht oplossingen bieden voor onder andere botaandoeningen, orgaanziekten en bloedziekten. Voor veel van deze aandoeningen is er op dit moment alleen behandeling voor de symptomen, maar niet voor de genezing van de ziekte. Regeneratieve geneeskunde zal de toekomst zijn voor deze selecte groepen van aandoeningen.
Gedifferentieerde cellen herprogrammeren
In de jaren ‘50 gebruikten onderzoekers vooral humane embryonale stamcellen. Hierbij werden met behulp van een vroegtijdig embryo stamcellen gebruikt om de gewenste gedifferentieerde cel te krijgen. Hierbij werd ook onderzocht of dit op een meer ethische manier kon worden onderzocht: een bevruchte eicel gebruiken ging voor veel mensen een stap te ver. Tegenwoordig gebruikt men andere methodes waarbij het mogelijk is om een gedifferentieerde cel (bijvoorbeeld hart- of levercellen) te herprogrammeren tot geïnduceerde pluripotente stamcellen. Deze cellen kunnen differentiëren naar een gewenst orgaan of weefsel. Lichaamscellen van de patiënt kunnen worden gebruikt om de iPSC’s (induced pluripotent stem cells) te vormen en deze therapeutisch toe te passen. Aangezien deze cellen genetisch identiek zijn, zullen deze niet worden afgestoten door het lichaam. Op dit moment worden voornamelijk huidcellen van de patiënten gebruikt om iPSC’s te maken. Het is nog niet bekend wat het precieze mechanisme in de cellen is. Daarnaast is het proces niet erg efficiënt: minder dan 1% van de cellen wordt geherprogrammeerd. iPSC’s worden gebruikt op meerdere vlakken van de wetenschap: weefsels bestuderen, ziekteprofielen ontdekken en testen wat de toxiciteit en werking van medicijnen zijn op het doelwitorgaan.
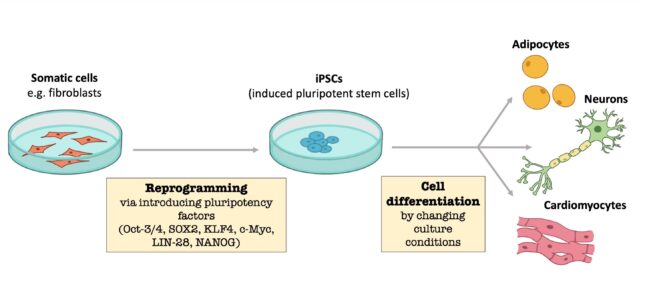
Regeneratieve geneeskunde in de praktijk
Artsen en onderzoekers bij het Leids Universitair Medisch Centrum (LUMC) passen op dit moment regeneratieve geneeskunde toe bij ziektes waarvoor nog geen goede alternatieve behandeling gevonden is. Een voorbeeld is Duchenne spierdystrofie (DMD), een erfelijke spierziekte die vooral voorkomt bij jongens waarbij kinderen op den duur de aangetaste spieren niet meer kunnen gebruiken. Voor DMD is op dit moment nog geen goede behandeling, dus krijgen kinderen hiervoor medicijnen die hun symptomen verlichten. Deze medicijnen zijn echter heel toxisch en zorgen voor veel bijwerkingen waardoor de behandeling met deze medicijnen vaak al snel wordt gestopt. Het LUMC is op dit moment een ‘exon skip therapie’ aan het onderzoeken, waarbij de afwijkende genetische code wordt hersteld. Hierdoor zullen de voorheen afwijkende eiwitten weer functioneren.
Voor hartziekten zijn er meer soorten behandelingen, waaronder leefstijlveranderingen, medicijnen of een operatie. Regeneratieve geneeskunde geeft de mogelijkheid om hartzieken nog beter aan te pakken. Hartritmestoornissen kunnen worden hersteld door lichtgevoelige ionkanalen te bouwen in de hartspiercellen. De elektrische activiteit kan met behulp van een lichtpuls worden bepaald, waardoor een gezond hartritme weer kan plaatsvinden. Een ander doel is om betere hartkleppen te genereren ter vervanging van verkalkte en versleten hartkleppen. Een methode wordt nu onderzocht om zieke hartkleppen te decellulariseren (de zieke cellen verwijderen van de hartklep, red.) en daarna te omringen met een gezond weefsel voorafgaand aan een transplantatie. Hiermee hopen de onderzoekers dat de hartkleppen langer meegaan.
Onze nieren filteren ons bloed en hebben daarom een belangrijke functie in ons lichaam. Deze functie brengt gevaar met zich mee, omdat nieren veel worden blootgesteld aan toxische stoffen. Het is nog niet mogelijk om chronisch nierfalen te herstellen; de enige behandeling op dit moment is een niertransplantatie. De wachtrijen zijn echter heel lang en veel patiënten komen niet aan de beurt. Regeneratieve geneeskunde biedt de mogelijkheid om de wachtrijen te verminderen en de kans op afstoting van het donororgaan te verkleinen. Na een niertransplantatie worden de patiënten behandeld met MSC’s (mesenchymale stromale cellen), een soort stamcellen die een sterke anti-inflammatoire werking hebben. Hierdoor kan het donororgaan langer meegaan en hoeven de patiënten minder afweer onderdrukkende medicijnen in te nemen. Bovendien wordt momenteel onderzocht of de donornieren kunnen worden gerevitaliseerd met MSC’s: Hiermee wordt de regeneratie van nierweefsel gestimuleerd. Daarenboven is het uiteindelijke doel om nierpatiënten te genezen zonder dat ze voor de rest van hun leven medicijnen moeten slikken; dit is alleen mogelijk als er lichaamseigen nieren worden gekweekt.
Een mijlpaal in Nederland
Zeer recentelijk hebben onderzoekers van het LUMC een debuut bekend gemaakt op het gebied van stamceltherapie. Na 15 jaar is een stamceltherapie ontwikkeld waarmee de zeldzame aangeboren immuunziekte Severe Combined Immunodeficiency (SCID) in pasgeborenen kan worden behandeld. Dit is een mijlpaal omdat voor de eerste keer is stamceltherapie in Nederland wordt toegepast op patiënten. Kinderen met SCID worden geboren met een tekort aan immuuncellen waardoor zij zonder behandeling niet ouder worden dan 1 jaar. Stamceldonoren vinden die volledig matchen met het HLA (antigenen die aanwezig zijn op alle lichaamscellen, behalve op de rode bloedcellen, red.) van de kinderen blijkt lastig, waardoor patiënten worden gematched aan donoren waarvan het HLA slechts gedeeltelijk overeenkomt. Stamceltherapie lost dit probleem op, omdat de pasgeborene zijn of haar eigen donor is. Er worden namelijk stamcellen afgenomen en verzonden naar het LUMC. Hier wordt de mutatie in de stamcellen gewijzigd, waarna de ‘gecorrigeerde’ stamcellen terug getransfundeerd worden in de pasgeborene. Volgens professor in stamcelbiologie Frank Staal en professor in kindergeneeskunde en stamceltransplantatie Arjan Lankester zal deze therapie deuren openen voor de behandeling van andere zeldzame ziektes.
Zoals de wetenschap al talloze malen heeft aangetoond, laten ook de ontwikkelingen in de regeneratieve geneeskunde zien dat de natuur dient als inspiratie voor indrukwekkende menselijke ontwikkelingen. Kreeften kunnen verloren lichaamsdelen weer aangroeien, dus waarom niet proberen dat ook bij mensen mogelijk te maken? Zeventig jaar geleden stond dit vak nog in de kinderschoenen, en nu zien we de eerste patiënten ermee behandeld worden. En wie weet, zullen de komende decennia nog veel meer mogelijkheden tonen om zieke lichaamsdelen te vervangen met deze elegante techniek.
Literatuur:
- Govind, C. K., Pearce, J., & Potter, D. J. (1988, december). Neural attrition following limb loss and regeneration in juvenile lobsters. PubMed. https://doi.org/10.1002/neu.48...
- Lau, W., Clevers, H., Strien, M., Burm, S., & Hol, E. (2016, 22 juni). Bekijk: Gekweekte mini-organen. NEMOKennislink. https://www.nemokennislink.nl/...
- Pittenger, M. F., Discher, D. E., Péault, B. M., Phinney, D. G., Hare, J. M., & Caplan, A. I. (2019, 2 december). Mesenchymal stem cell perspective: cell biology to clinical progress. npj Regenerative Medicine. https://www.nature.com/article...
- Roelen, B. (2016, 22 juni). Geïnduceerde pluripotente stamcellen. NEMOKennislink. https://www.nemokennislink.nl/...
- Spierziekten Nederland: Duchenne spierdystrofie (DMD). (z.d.). Spierziekten Nederland. Geraadpleegd op 8 februari 2021 https://www.spierziekten.nl/ov...
- UMC Utrecht. (z.d.). Regeneratieve geneeskunde en stamcellen. Geraadpleegd op 8 februari 2021, van https://www.umcutrecht.nl/nl/z...
- Rathenau Instituut. (2018, 8 mei). Regeneratieve geneeskunde: behandeling van de toekomst? https://www.rathenau.nl/nl/maa...





0 Reacties
Geef een reactie