Menselijke genmodificatie: science (non-)fiction?
Menselijke genmodificatie is al heel lang een populair onderwerp in sciencefiction. Sommige van deze verhalen, zoals GATTACA en The Island of Dr. Moreau, schetsen dystopische werelden die worden gekenmerkt door sociale ongelijkheid, genetische afwijkingen en discriminatie.
Andere verhalen, zoals Elysium en Deadpool, tonen ook juist de wereldveranderende belofte van het verbeteren van de menselijke vermogens of het uitroeien van ziektes. Vandaag de dag komen deze ooit fictieve concepten steeds dichter bij de realiteit, nu de eerste medische toepassingen van genetische modificatie de weg naar de kliniek vinden. Dat roept de vraag op: zal menselijke genmodificatie in de realiteit een even transformerende rol spelen als in de verhalen?
Moderne genmodificatie: CRISPR/Cas9
De realiteit van de moderne genmodificatie begon in 2012 met de ontdekking van CRISPR/Cas9. Dit RNA-eiwit complex is een natuurlijk voorkomend verdedigingssysteem van bepaalde bacteriën en archaea, maar onderzoekers hebben het een nieuw doel gegeven als gereedschap voor het aanpassen van genen. Het systeem wordt vaak omschreven als een soort moleculaire schaar, die als het ware door het DNA heen knipt en daarmee hele gerichte breuken in het genoom creëert. Wanneer zo’n breuk optreedt, heeft de cel meerdere mogelijkheden om het DNA te herstellen, elk met andere gevolgen voor de genetische code.
Stel je, ter illustratie van de twee DNA-herstelstrategieën, een schaar voor die een boek in twee stukken knipt. De schaar representeert hier CRISPR/Cas9, en het boek het DNA. De simpelste en de snelste manier om de schade aan het boek te herstellen, is om de stukken onmiddellijk aan elkaar te plakken zonder te letten op hoe de zinnen op elkaar aansluiten. Deze “quick-fix” herstelstrategie is analoog aan het mechanisme van ‘Non-homologous end joining’ (NHEJ), waarbij de gebroken DNA-strengen direct weer aan elkaar worden gekoppeld. Maar, zoals de analogie suggereert, kan het voorkomen dat de zinnen in het boek - de data uit de DNA-streng - misschien niet meer leesbaar zijn. De herstelde streng kan namelijk fouten bevatten en informatie missen, waardoor een gen op de plaats van de breuk is uitgeschakeld.
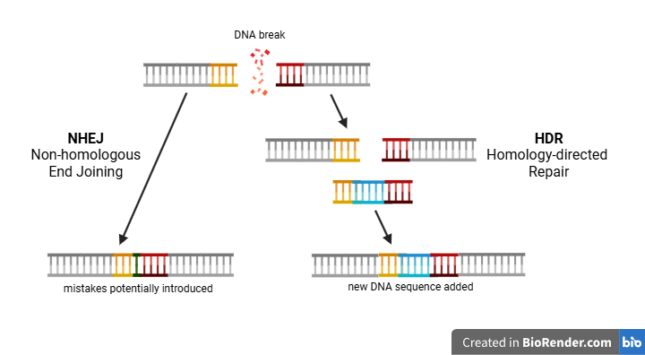
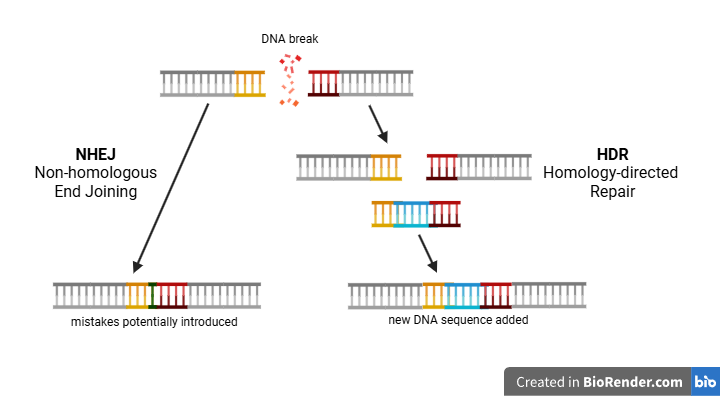
De alternatieve en complexere strategie houdt in dat de kapotte pagina’s nauwkeurig op elkaar worden afgestemd door te kijken naar dezelfde pagina in een ander exemplaar van het boek. Deze “high-fidelity” herstelstrategie is een weerspiegeling van het mechanisme van ‘Homology-directed repair’ (HDR). Nadat een breuk in het DNA is aangebracht, vult HDR de originele sequentie aan op basis van een vergelijkbare DNA-template. Als een dergelijke template op de plek van de breuk kleine aanpassingen bevat, introduceert HDR deze veranderingen vervolgens in het genetisch materiaal.
Behandeling van sikkelcelziekte
In 2023, elf jaar na de ontdekking, werd een CRISPR/Cas9 gebaseerde therapie goedgekeurd voor de behandeling van sikkelcelziekte (SCZ). Deze ziekte wordt veroorzaakt door een mutatie in het β-globine gen, wat resulteert in de productie van het abnormale hemoglobine S (HbS). Als het zuurstofgehalte in het bloed laag is, klontert HbS samen en hierdoor nemen de rode bloedcellen een karakteristieke sikkelvorm aan. In tegenstelling tot hun normale, schijfvormige tegenhangers, hebben de sikkelcellen een kortere levensduur, zijn minder flexibel en kunnen bovendien bloedvaten blokkeren. Dit leidt tot een verminderde zuurstoftoevoer, progressieve orgaanschade, en een potentiële vroege dood voor mensen die aan deze ziekte lijden.
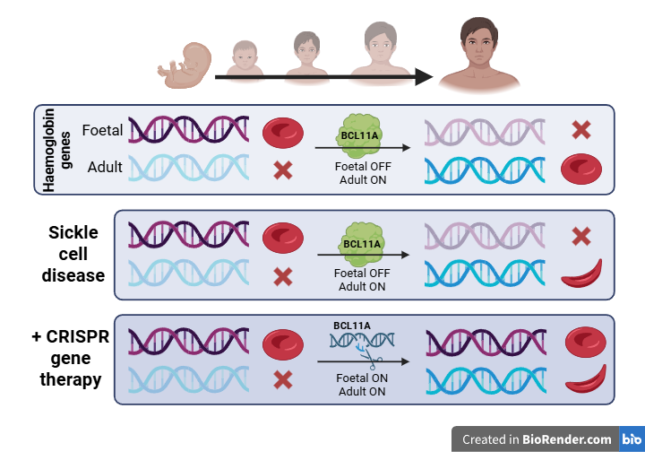
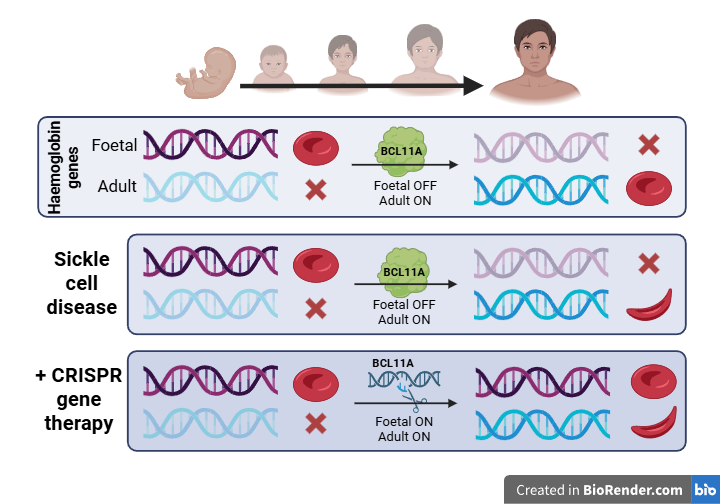
Een voor de hand liggende, maar technisch complexe oplossing is om SCZ te behandelen door de mutatie te herstellen met HDR. Zoals eerder beschreven, is HDR echter moeilijk te realiseren in patiënten. Daarom maken de onderzoekers gebruik van de makkelijkere NHEJ route om de functie van hemoglobine indirect te herstellen. Rode bloedcellen bevatten namelijk ook het gen voor foetaal hemoglobine, dat meestal een paar weken na de geboorte gedeactiveerd wordt door een ander gen, genaamd BCL11A. Door met behulp van CRISPR/Cas9 een breuk in BCL11A te introduceren, kan dit gen worden verstoord door NHEJ. Zo wordt de productie van foetaal hemoglobine herstart en wordt de normale werking van rode bloedcellen hersteld.
Om te zorgen dat foetaal hemoglobine geproduceerd wordt in de rode bloedcellen, moet de modificatie met CRISPR/Cas9 gehanteerd worden in de voorlopercellen, genaamd hematopoietische stamcellen (HSC). Allereerst worden de HSC’s geïsoleerd uit het beenmerg, waarna CRISPR/Cas9 kan worden toegepast. Het behandelen van de cellen buiten het lichaam (“ex vivo”) zorgt voor precieze controle over de aangepaste cellen. De gemodificeerde HSC’s worden dan opnieuw aangebracht in de patiënt, waar ze het beenmerg herbevolken en gezonde rode bloedcellen beginnen te produceren. Deze behandeling, Casgevy genoemd, liet goede resultaten zien tijdens de klinische proeven: bij 97% van de patiënten werd een vermindering van acute SCZ gerelateerde symptomen geconstateerd.1
Behandeling van transthyretine-amyloïdose
Naast dergelijke “ex vivo” toepassingen is CRISPR/Cas9 ook binnen het menselijk lichaam (“in vivo”) toegepast, voor de behandeling van Transthyretine-amyloïdose (ATTR). ATTR wordt veroorzaakt door mutaties in het transthyretine (TTR) gen, wat leidt tot een productie van verkeerd gevouwen TTR eiwitten. Deze misvormde eiwitten klonteren samen en hopen op in weefsels zoals het hart en de zenuwen, en zorgen daarmee over tijd voor orgaanschade.
De behandeling van ATTR heeft als doel de productie van TTR te verminderen. Hiervoor wordt CRISPR-Cas9 in het lichaam toegediend om een NHEJ-afhankelijke verstoring in het TTR-gen te veroorzaken. De therapie, bekend onder de naam NTLA-2002, is op dit moment in de laatste fases van klinische proeven en is het eerste voorbeeld van een “in vivo” CRISPR/Cas9 behandeling die wordt getest op mensen. Uit aanvankelijke resultaten blijkt dat een enkele dosis de concentratie van TTR eiwitten met meer dan 80% kan verminderen. Op basis van deze bevindingen wordt verwacht dat de ontwikkeling van de ziekte na behandeling sterk vertraagt of zelfs volledig tot stilstand komt.2
De toekomst van CRISPR/Cas9 behandelingen
De bestaande klinische toepassingen van CRISPR/Cas9 demonstreren al de potentie van CRISPR/Cas9 als een hervormend klinisch hulpmiddel. Het volgende hoofdstuk van het onderzoek draait nu om het veranderen van genetische code met HDR - zelfs dicht bij huis. Een onderzoeksgroep aan het LUMC probeert gebruik te maken van een HDR-afhankelijke CRISPR/Cas9 technologie voor de behandeling van “severe combined immunodeficiency” (SCID). Ongeveer 20% van SCID gevallen wordt veroorzaakt door mutaties in het RAG gen, dat codeert voor een essentieel eiwit in de immuunregulerende T- en B-cellen. Zonder functionerende T- en B-cellen lijden patiënten aan een ernstig verstoord immuunsysteem, wat vaak leidt tot een vroege dood.
Potentiële behandelingen met HDR
In principe kunnen de onderliggende mutaties van RAG-SCID gecorrigeerd worden door middel van een CRISPR/Cas9 behandeling met een DNA-template van het correcte gen. Bovendien zou deze behandeling, net als bij de sikkelcelziekte, “ex vivo” kunnen plaatsvinden, gezien HSC’s ook de voorlopers zijn van T- en B-cellen. Deze strategie is al getest in een preklinisch onderzoek met muismodellen.3 Na de transplantatie van de gemodificeerde HSC’s observeerden de onderzoekers een herstel in de RAG-expressie en functionaliteit, wat op zijn beurt voor een succesvol herstel in de ontwikkeling van T- en B- cellen zorgde. Hiermee geeft deze studie een goed beeld van het potentiële gebruik van HDR-correctie voor de behandeling van RAG-SCID, hoewel er nog veel inspanning nodig is om dit daadwerkelijk toegankelijk te maken voor mensen.
De verwezenlijking van deze vroege HDR-gebaseerde CRISPR/Cas9 technieken zetten de basis voor het volgende hoofdstuk in het verhaal: een toekomst waarin het herschrijven van de genetische code de mogelijk biedt de behandeling van tal van genetische ziektes te revolutionaliseren.4 Voorbeelden van dergelijke ziektes zijn: cystische fibrose, amyotrofe laterale sclerose en de ziektes van Duchenne, Huntington en Gauchier.
Resterende uitdagingen voor CRISPR/Cas9 behandelingen
Echter, het feit dat deze behandelingen nog niet gerealiseerd zijn, benadrukt de vele resterende uitdagingen van CRISPR/Cas9 gebaseerde therapieën. Deze uitdagingen omvatten onder andere: het ontwerpen van een veilige en efficiënte methode voor het afleveren van CRISPR/Cas9, ongewenste neveneffecten en het tegengaan van immuunactivatie.5 Naast deze technische hordes, mogen verscheidene ethische grenzen niet achterwege gelaten worden. Een voorbeeld hiervan is het aanpassen van kiemlijncellen. Na modificatie wordt het genetische materiaal van deze cellen overgedragen aan de volgende generatie. Dit zal onomkeerbare veranderingen met zich meedragen in het genoom van de mensheid. Daarnaast is het belangrijk om grenzen te stellen aan het gebruik van CRISPR/Cas9 voor gevaarlijke en niet noodzakelijke toepassingen. Ten slotte moet sociale gelijkheid in acht worden genomen om te voorkomen dat de dystopische ongelijkheden uit sciencefiction geen realiteit worden.
Conclusie
Met de adoptie van CRISPR/Cas9 is de modificatie van menselijke genen geen sciencefiction meer, maar enkel nog een prille medische realiteit. De eerste klinische successen, zoals de behandeling van SCZ en ATTR, laten nu al de transformatieve mogelijkheden zien. In de toekomst kunnen de onderzoeken naar HDR-afhankelijke modificaties verbetering betekenen voor de behandeling van een verscheidenheid aan erfelijke ziektes. Kortom, het verhaal van CRISPR/Cas9 is nog lang niet voorbij, en voorlopig moeten we het doen met een ontrafelende cliffhanger.
Sources
- Frangoul, H., Locatelli, F., Sharma, A., Bhatia, M., Mapara, M., Molinari, L., Wall, D., Liem, R. I., Telfer, P., Shah, A. J., Cavazzana, M., Corbacioglu, S., Rondelli, D., Meisel, R., Dedeken, L., Lobitz, S., De Montalembert, M., Steinberg, M. H., Walters, M. C., . . . Grupp, S. A. (2024). Exagamglogene Autotemcel for Severe Sickle Cell Disease. New England Journal Of Medicine, 390(18), 1649–1662. https://doi.org/10.1056/nejmoa...
- Gillmore, J. D., Gane, E., Taubel, J., Kao, J., Fontana, M., Maitland, M. L., Seitzer, J., O’Connell, D., Walsh, K. R., Wood, K., Phillips, J., Xu, Y., Amaral, A., Boyd, A. P., Cehelsky, J. E., McKee, M. D., Schiermeier, A., Harari, O., Murphy, A., . . . Lebwohl, D. (2021). CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. New England Journal Of Medicine, 385(6), 493–502. https://doi.org/10.1056/nejmoa...
- Castiello, M. C., Brandas, C., Ferrari, S., Porcellini, S., Sacchetti, N., Canarutto, D., Draghici, E., Merelli, I., Barcella, M., Pelosi, G., Vavassori, V., Varesi, A., Jacob, A., Scala, S., Ricci, L. B., Paulis, M., Strina, D., Di Verniere, M., Sergi, L. S., . . . Villa, A. (2024). Exonic knockout and knockin gene editing in hematopoietic stem and progenitor cells rescues RAG1 immunodeficiency. Science Translational Medicine, 16(733). https://doi.org/10.1126/scitra...
- Knott, G. J., & Doudna, J. A. (2018). CRISPR-Cas guides the future of genetic engineering. Science, 361(6405), 866–869. https://doi.org/10.1126/scienc...
- Uddin, F., Rudin, C. M., & Sen, T. (2020). CRISPR gene therapy: applications, limitations, and implications for the future. Frontiers in Oncology, 10. https://doi.org/10.3389/fonc.2020.01387






0 Reacties
Geef een reactie