Toveren met CRISPR-Cas: Een eenhoorn knutselen met DNA
Altijd al een eenhoorn gewild? Of een lichtgevend konijn? Om te kijken of dit feit of fictie is, gaat redacteur Soraya Schachtschabel in gesprek met de experts.
Er kan steeds meer in de wereld van de wetenschap. Een aap het spelletje pong laten spelen met zijn gedachten, een lekker biefstukje maken van kweekvlees en auto’s die zelf rijden. Maar kunnen we onze kennis ook gebruiken om magie tot leven te wekken? In dit artikel zoek ik uit of we eenhoorns kunnen maken met gene editing. Nieuwsgierig? Lees verder voor het antwoord!
Gene editing is een verzamelterm voor microbiologische technieken die DNA aanpassen. Door die aanpassingen kunnen eigenschappen van organismen veranderen of nieuwe eigenschappen ontstaan. De nieuwste techniek op dit vlak is CRISPR-Cas, een moleculaire schaar die DNA knipt op precies die plek waar onderzoekers dat willen.
“Oorspronkelijk is CRISPR-Cas het verdedigingsmechanisme van bacteriën tegen bacteriofagen (virussen die bacteriën aanvallen, red.)”, legt hoogleraar en afdelingshoofd Humane Genetica Silvère van der Maarel uit. “Het systeem knipt en maakt DNA kapot, maar door allerlei bewerkingen in het lab zijn er talloze varianten van gemaakt. Door dan te fuseren aan moleculen met andere functionaliteiten kan je van alles doen met DNA op die plek waar jij graag wilt.” Zo kan je een gen – een stukje DNA code – verwijderen, toevoegen, veranderen, uitzetten of aanzetten. Klinkt als een goede techniek om een mythisch wezen mee te bouwen.
Wondermiddel?
Vergeleken met oudere gene editing technieken heeft CRISPR-Cas veel voordelen. “Het geeft mogelijkheid tot veel variabiliteit zodat je er verschillende dingen mee doen, de precisie waarmee je dingen kunt doen is heel hoog en de selectiviteit van nieuwe CRISPR-Cas vormen is steeds beter”, meldt Van der Maarel. Daarnaast kan genetische modificatie nu veel sneller uitgevoerd worden. “Vroeger waren we jaren bezig met genetische aanpassingen, nu doe je het in een paar weken. Als je een gen wilt veranderen dan doe je dat gewoon even.”
Het gebruik van CRISPR-Cas kent al vele succesverhalen. Vorig jaar nog is voor het eerst een patiënt in vivo behandeld tegen blindheid door een enkele mutatie aan te brengen in oogcellen. CRISPR-Cas lijkt zo onderhand wel de oplossing voor elk probleem op genetisch niveau. “Maar”, stelt Van der Maarel, “het is geen magic bullet, wondermiddelen bestaan niet. Ook CRISPR-Cas heeft last van specificiteit die te laag is, niet efficiënt de targetcellen kunnen bereiken en het kunnen veroorzaken van immuunreacties, net als andere technieken.”
Mythisch design
Kunnen we dan wel CRISPR-Cas gebruiken om een eenhoorn te maken? Van der Maarel is positief: “Ja, waarom niet? Je kan een paard met een hoorn van een narwal combineren. Daarbij moet je wel beseffen dat het veel complexer is dan je denkt. Het is echt niet zo van je zet twee genen aan en je krijgt een hoorn op dat voorhoofd. Het is een hele complexe ontwikkelingsbiologie die daarachter zit, waar een heel samenspel van genen ervoor zorgt dat deze structuur gebouwd wordt.”
Daar is ontwikkelingsbioloog Maurijn van der Zee het mee eens. Normaal richt hij zich op insecten, maar voor dit vraagstuk maakt hij graag een uitstapje naar gewervelden. “Technisch is het uiteindelijk vast mogelijk om een eenhoorn te maken, maar je moet wel eerst weten hoe een hoorn zich ontwikkelt in het oorspronkelijke dier. Bij een narwal is de hoorn eigenlijk een tand, dus zou je een tand van een paard kunnen aanpassen met behulp van narwal DNA. Daarnaast zou je ook de hoorn van een neushoorn kunnen gebruiken.” Het probleem bij beide dieren is dat het niet bepaald modelorganismen zijn en er niet veel bekend is over de ontwikkelingspaden. “We weten al niet hoe een tand zich precies ontwikkelt in een muis, het bekendste modelorganisme, laat staan bij een narwal.” Kortom, we weten nog te weinig over hoe een hoorn groeit bij een narwal of een neushoorn om te snappen wat we moeten en kunnen veranderen in het paard om een hoorn te laten groeien.
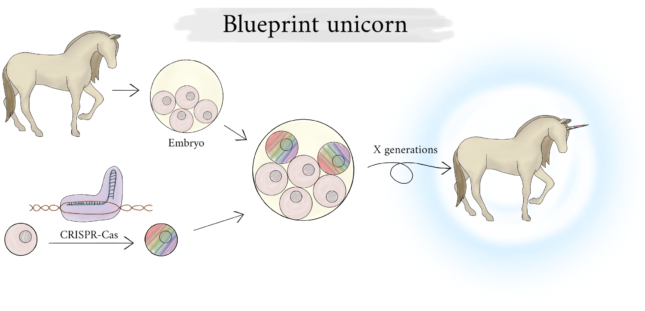
Maar zodra we dat wel hebben uitgevogeld, hoe zouden we dan paarden kunnen veranderen in eenhoorns? “Je moet echt in de basis sleutelen omdat je genetische ontwikkelingspaden moet aanpassen. Dan kan je niet zomaar een paar huidcellen aanpassen en opeens gaat er een hoorn groeien. Het beste is om in het beginstadium van een embryo genetisch gemodificeerde stamcellen toe te voegen”, licht Van der Zee toe. Een nadeel is dat je niet alle aanpassingen in één keer kan doen, daar gaan generaties paarden overheen. Per generatie is dat een lange tijd. “Kijk, bij een muis doet een promovendus al gauw twee jaar over het maken van een genetisch gemodificeerde variant, terwijl muizen in vergelijking een zeer korte generatietijd hebben. Moet je nagaan hoe lang het duurt voordat je een eenhoorn hebt.”
Illegale eenhoorns
Naast de vraag of we een eenhoorn kunnen bouwen, rest de vraag of we dat wel willen en mogen. Wat heeft een paard aan een hoorn en kunnen er geen complicaties ontstaan door ons geknutsel met DNA? Wat is het nut van het creëren van eenhoorns, naast dat ze een speciale toevoeging voor de kinderboerderij zouden zijn? Dat zijn kwesties waarover de samenleving zich moet buigen, niet alleen voor vragen als deze maar ook voor serieuze zaken.
Qua regelgeving is het helaas op dit moment ook niet mogelijk om een eenhoorn te maken. “De regelgeving loopt in Europa nogal achter ten opzichte van wat er mogelijk is. Die regelgeving is misschien wel 40 jaar oud, terwijl de methodes en mogelijkheden zoveel zijn veranderd”, constateert universitair docent Sylvia de Pater. Ze gebruikt zelf CRISPR-Cas in haar onderzoek naar DNA-herstelroutes in plantencellen. “Ik vind zelf het argument dat je nu precies kan zien wat je eindproduct is – doordat je de genetische code van een genetisch gemodificeerd organisme van voor naar achteren kan lezen – wel een argument dat je de regelgeving moet aanpassen. Ik zeg hiermee niet dat het helemaal vrij moet, omdat je dan mensen krijgt die rare dingen gaan doen ermee.” Zoals een eenhoorn maken dus.
Voor nu lijkt het nog niet haalbaar om een eenhoorn te bouwen met CRISPR-Cas, maar mogelijk leren we in de komende jaren meer over de ontwikkelingspaden van hoorns en mogen we iets meer van de wet. Wie weet, misschien zijn deze mythische wezens over een paar eeuwen toch te vinden in een futuristische kinderboerderij.
Extra: CRISPR-Cas onderzoek in Leidse Labs
Silvère van der Maarel, LUMC
Al ruim twintig jaar
doet Van der Maarel onderzoek naar de ongeneeslijke spierziekte FSHD.
Bij deze ziekte staat de transcriptiefactor DUX4 aan in spiercellen
terwijl dat niet hoort. Een transcriptiefactor kan andere genen
aanzetten. In dit geval veroorzaakt DUX4 ernstige spierzwakte en
atrofie. Om te zien of CRISPR-Cas een rol kan spelen in de behandeling
van deze ziekte, kweekte Van der Maarel met zijn onderzoeksteam cellen
van FSHD-patiënten en corrigeerde een mutatie in het DNA die specifiek
is voor FSHD met behulp van CRISPR-Cas. De aangepaste cellen
produceerden hierdoor veel minder DUX4, een mooi resultaat voor
hoopvolle patiënten.
Sylvia de Pater, IBL
Net zoals CRISPR-Cas is
afgekeken van een bacteriesysteem, werkt De Pater ook met een DNA
systeem gebaseerd op een overlevingstechniek van bacteriën. Het gaat
hierbij om het T-DNA van Agrobacterium. Die bacterie brengt
namelijk dit stukje eigen DNA binnen bij een plantencel waardoor het de
plant aanzet tot het maken van opines, producten die alleen die
specifieke bacterie kan gebruiken. Daarnaast zitten er ook genen op het
T-DNA voor planthormonen, zodat er een tumor op de plant ontstaat en
deze heel veel opines produceert. Zo doet de bacterie eigenlijk aan
landbouw.
De Pater onderzoekt hoe het integreren van het T-DNA in het plantengenoom werkt en hoe dit systeem geoptimaliseerd kan worden voor gebruik in de plantenindustrie om transgene planten te maken. Daarbij focust ze zich op herstelroutes van dubbelstrengsbreuken in het DNA en bestudeert ze deze routes in verschillende mutanten van de Arabidopsis plant door breuken te maken in het DNA met CRISPR-Cas.
Maurijn van der Zee, IBL
Voor zijn onderzoek naar
de ontwikkeling van meelkevers heeft Van der Zee het DNA van twee
groepen meelkevers met elkaar vergeleken. De ene groep heeft een snelle
ontwikkeling in het ei en de andere groep een langzame. Wat blijkt, er
is een genetische verandering op één punt in het hormoon ecdysone. Dit
eiwit speelt al een rol bij de vorming van de pop van insecten, maar zou
dus ook een rol kunnen spelen bij de ontwikkeling in het ei. Dat gaat
van der Zee nu onderzoeken door de mutatie na te bootsen met CRISPR-Cas.
Ontdekken hoe een insect zijn ontwikkeling en de timing ervan kan
reguleren leert ons veel over hoe ze zich aanpassen ten opzichte van
global warming.






0 Reacties
Geef een reactie